입력 2025.08.18 10:26
- 연세대 송재환 교수팀, 암·감염질환 치료 실마리 제시
- 연구성과 국제학술지 Nature Communications 게재

연세대학교 생화학과 송재환 교수 연구팀(제1저자: 황치현 석박사통합과정)이 세포가 스스로 죽는 현상인 ‘세포사멸’의 한 형태인 네크롭토시스를 정밀하게 조절하는 단백질 메커니즘을 새롭게 규명했다. 연구 성과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications) 8월 9일자 온라인판에 게재됐다.
세포사멸은 손상되거나 더 이상 필요 없는 세포를 제거해 몸의 균형을 유지하는 생명 유지 메커니즘이다. 이 과정에 이상이 생기면 암, 자가면역질환, 감염질환 등 다양한 질병이 발생할 수 있다.
기존에는 ‘아폽토시스’라는 형태의 세포사멸이 잘 알려져 있었지만, 최근에는 네크롭토시스라는 또 다른 경로가 주목받고 있다. 네크롭토시스는 바이러스나 세균이 아포토시스를 피할 때, 면역계가 이를 우회해 세포를 제거하는 방식으로 작동한다.
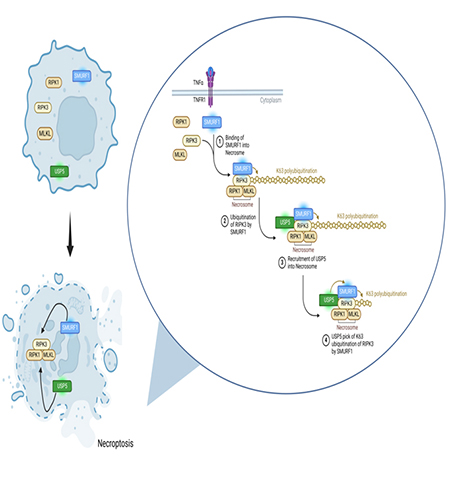
이 메커니즘의 핵심 단백질은 RIPK3다. 이 단백질은 특정 자극을 감지하면 MLKL이라는 또 다른 단백질을 활성화시켜 세포막을 파괴하고, 세포사멸과 면역 반응을 유도한다. 쉽게 말해, RIPK3는 세포의 ‘사형 집행자’ 역할을 하며, 이 단백질의 상태를 조절하는 것은 세포의 생사 여부를 결정짓는 ‘최종 스위치’를 제어하는 것과 같다.
송 교수팀은 이 RIPK3 단백질이 ‘유비퀴틴화’(단백질에 유비퀴틴이라는 분자를 붙여 기능을 조절하는 과정)라는 과정을 통해 조절된다는 점에 주목했다.
연구 결과, SMURF1이라는 단백질은 RIPK3의 특정 아미노산(K55, K363)에 유비퀴틴 사슬을 붙여 세포사멸을 억제하는 반면, USP5라는 단백질은 이 유비퀴틴 사슬을 제거해 세포사멸을 촉진하는 것으로 확인됐다. 즉, 두 단백질이 RIPK3의 작동 여부를 서로 반대로 조절하며 세포의 운명을 가르는 데 직접적인 영향을 미친다.
연구팀은 이 조절 메커니즘이 실제 암세포에서도 효과가 있는지를 확인하기 위해, 골수성 백혈병(Molm-13) 세포를 이용해 실험을 진행했다. SMURF1을 억제하거나, RIPK3의 유비퀴틴 결합 부위를 변형시킨 돌연변이(K55R, K363R)를 도입하고, USP5를 과발현시켜 네크롭토시스를 촉진했을 때, 종양 성장 억제 효과가 뚜렷하게 나타났다.
특히, 기존에 알려진 약물인 비리나판트(Birinapant)와 엠리카산(Emricasan)을 병용할 경우, 항암 효과가 더욱 극대화되는 것도 확인됐다.
송재환 교수는 “이번 연구는 RIPK3를 매개로 한 세포사멸 경로를 분자 수준에서 정밀하게 규명한 첫 사례”라며, “향후 암은 물론 자가면역질환, 감염성 질환, 패혈증 등의 치료 전략 개발에 중요한 기초자료로 활용될 수 있을 것”이라고 강조했다.
이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 글로벌 중견연구, 창의연구과제, 박사과정생 연구장려금, 연세대 BK21 FOUR 프로그램의 지원을 받아 수행됐다.